Nos recherches visent à comprendre comment l’organisation supérieure de la chromatine est impliquées dans le contrôle de l’expression des gènes chez les mammifères dans des situations normales ou pathologiques.
Grâce au développement de techniques expérimentales et d'outils de modélisation originaux, notre équipe s’intéresse aux propriétés de l'organisation de la chromatine à deux niveaux importants : les domaines d'association topologique (TADs) et les compartiments nucléaires.
1.Coordination de l’expression des gènes chez les mammifères à l’intérieur des TADs
Notre équipe a contribué au développement des technologies de Capture de Conformation de Chromosome (3C) en améliorant la sensibilité des tests de 3C (méthode 3C-qPCR) (Hagège et al., Nature Protocols 2, 1722, 2007; Rebouissou et al., Meth. Mol. Biol. 2532, 187-197, 2022). Grâce à l’utilisation de de cette méthode, nous avons montré que les loci riches en gènes possèdent des fréquences de contacts modulées périodiquement en fonction de la distance séparant les sites le long du génome (Court et al., Genome Biol. 12, R42, 2011). Après avoir initié une collaboration interdisciplinaire avec Annick Lesne, physicienne, nous avons montré que cette modulation peut être décrite par des modèles dérivés de la physique des polymères, comme si la chromatine était repliée statistiquement en forme d’hélice (modèle d’hélice statistique, voir figure) (Ea et al., Genes 6, 734-750, 2015). Nous avons ensuite montré que, en raison de leur taille différente, des principes distincts de la physique des polymères régissent la dynamique de la chromatine dans les domaines topologiques de la souris et de la mouche Drosophile (Ea et al., BMC Genomics 16, 607, 2015; collab. avec G. Cavalli, IGH, Montpellier).
Plus récemment, nous avons montré que certaines séquences rétrovirales endogènes (ERV) agissent dans le génome de la souris comme des activateurs transcriptionnels (« enhancers ») putatifs contrôlant l'expression de gènes endogènes par le biais d'interactions chromatiniennes à longue distance contrôlées par HP1 (Heterochromatin Protein 1) (Calvet et al., Cells 11, 2392, 2022 ; collab. avec F. Cammas, IRCM, Montpellier).
Enfin, dans une étude in-silico, grâce à l’utilisation de données d’association génétique (GWAS), nous avons montré que, pour une fraction des maladies humaines, les variants nucléotidiques à risque (daSNPs) sont préférentiellement localisés dans les bordures de domaines topologiques (TADs) (Jablonski et al., Human Genomics, 16, 2, 2022; collab. avec M.T. Hütt, Brême, Allemagne). Les cancers sont relativement plus fréquents parmi ces maladies et nous caractérisons maintenant l’organisation 3D de la chromatine d’un locus paradigmatique associé à un risque élevé de cancer du poumon.
2.Corps nucléaires et organisation supérieure de la chromatine chez les mammifères
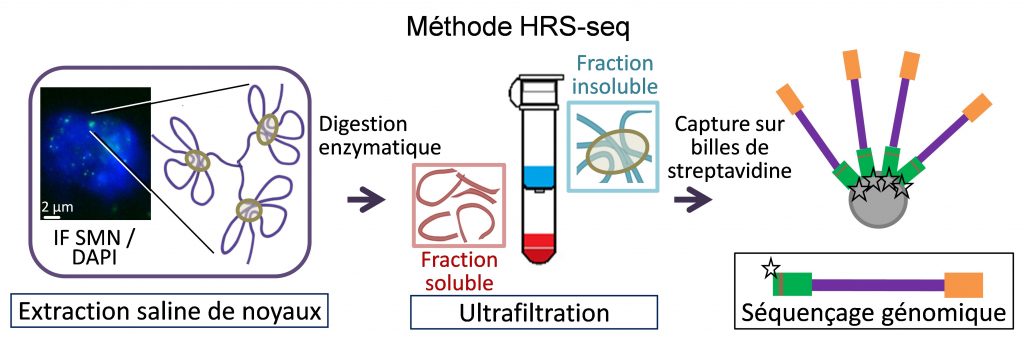
Les corps nucléaires sont des organelles nucléaires non-membranaires qui se comportent comme des gouttelettes lipidiques. Beaucoup d’entre eux s’assemblent in vivo par des processus de séparation de phase et jouent un rôle essentiel dans la coordination de l’expression des gènes en confinant ensemble des régions chromatiniennes spécifiques dispersées dans le génome (Lesne et al., Genes 10, 1049, 2019). Nous avons développé une nouvelle méthode, appelée HRS-seq (High-salt Recovered Sequences-sequencing), permettant l’analyse génomique par séquençage à haut-débit des régions associées aux larges complexes ribonucléoprotéiques (RNPs) du noyau incluant plusieurs types de corps nucléaires. Dans les cellules souches embryonnaires (ES) de souris, nous avons montré que le compartiment chromosomique actif est associé à de tels complexes RNPs (Baudement et al., Genome Res. 28, 1733-1746, 2018; collab. avec L. Journot, IGF, Montpellier et J. Mozziconacci, MNHN, Paris ).
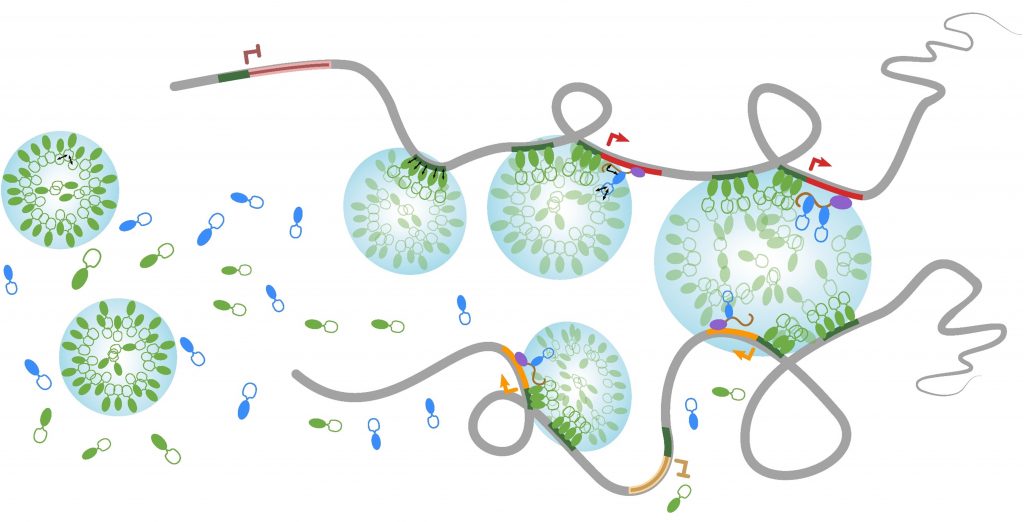
Nous explorons maintenant le rôle que ces corps nucléaires jouent dans l'organisation supérieure de la chromatine et dans le contrôle de l'expression des gènes, pendant la différenciation cellulaire ou dans certaines situations pathologiques. Afin d'identifier plus précisément les gènes associés à une classe spécifique de corps nucléaires, nous tentons d’adapter la méthode HRS-seq en agissant sur les paramètres physiques de la séparation de phase (projet ARGECOR 80Prime, soutenu par la mission interdisciplinaire du CNRS - MITI).


