| Protéine | Tag | Poids moléculaire | Concentration | Tampon de stockage |
| TEV protease | 6His | 27 kDa | 0,8 mg/mL | 50 mM HEPES pH 7,5 – 1 mM DTT – 45% glycerol |
| Cas9-GFP | 6His, MBP | 236 kDa | 3,7 mg/mL | 20 mM HEPES pH 7,5 – 150 mM KCl – 1 mM DTT – 50% glycerol |
(*): ces protéines seront à terme distribuées via le magasin. Dans l’immédiat, vous pouvez vous les procurer en les demandant directement à Sarah Benlamara ou Olivier Coux.
Procédures et contrôles de qualité :
TEV protease :
La protéase a été exprimée en utilisant le plasmide 6His-pTEV (backbone pET28 - carte disponible sur demande), dans la souche E.coli Rosetta pLysS. Elle a ensuite été purifiée par affinité sur une colonne Ni-NTA, puis par échange d’anions après dessalage. La fraction pure a été centrifugée pour enlever les agrégats et stockée dans 50% glycérol.
Son activité a ensuite été testée en utilisant la Cas9-GFP, qui présente un site TEV entre le tag 6H-MBP et la Cas9-GFP.
L’efficacité de coupure dépend de l’accessibilité du site de fixation de l’enzyme et peut donc varier énormément d’un susbtrat à l’autre. Nous recommandons d’adapter la quantité de TEV au substrat, en réalisant une gamme en quantité décroissante de TEV à partir de 1 µg de TEV pour 1 µg de substrat.
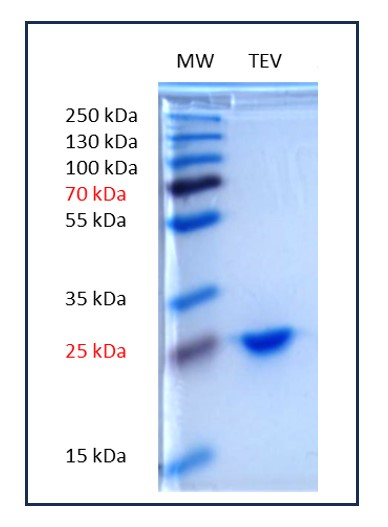
Analyse de la pureté (Coomassie – 10% acrylamide) :
Cas9-GFP
La protéine a été exprimée à partir de la construction 6His-MBP-Cas9-GFP (addgene pMJ922) dans la souche E.coli Rosetta pLysS. Elle a été purifiée selon les étapes suivantes :
- Affinité sur colonne Ni-NTA
- Echange de cations sur colonne MonoS
- Gel filtration sur colonne Superdex 200.
Elle a été ensuite concentrée (Vivaspin) à 3,7 mg/mL .
Analyse de l'activité :
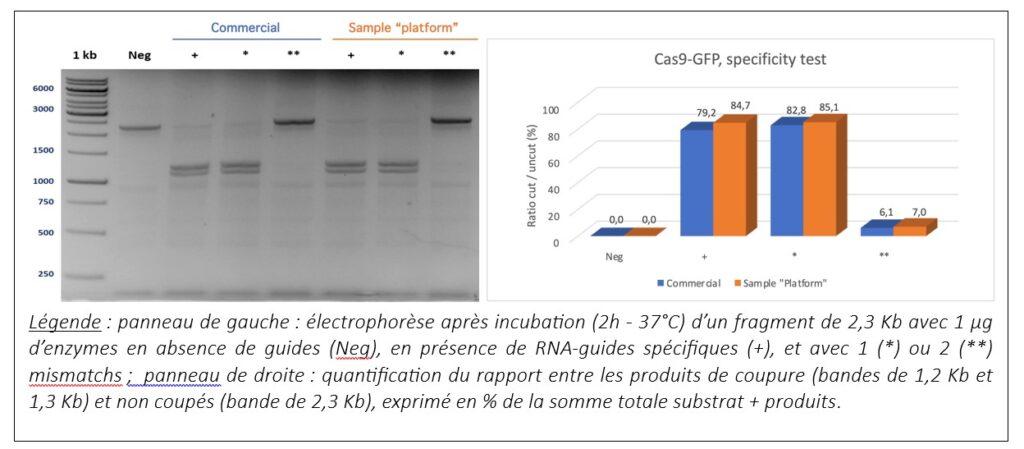
L’activité de la Cas9-GFP a été testée in vitro en la comparant avec une Cas9 commerciale. Deux tests ont été réalisés : un test d’efficacité et un test de spécificité. L’échantillon produit par la plateforme donne des résultats comparables à l’enzyme commerciale.
Efficacité :

Spécificité :