L'inflammation est une réaction normale du système immunitaire en réponse à des infections ou à des lésions tissulaires. C’est une composante de la réponse immunitaire innée qui est déclenchée par un large éventail de facteurs, comprend de mécanismes et de voies de signalisation, qui convergent tous vers la production de médiateurs solubles de l'inflammation (cytokines et chimiokines). Les réponses inflammatoires bénéfiques sont généralement initiées localement, au site de l'infection ou de la lésion, et constituent une étape de signalisation centrale vers l'activation des réponses immunitaires adaptatives. Une fois l'infection éliminée ou la lésion guérie, la réponse inflammatoire est résolue, afin de limiter l'activation du système immunitaire.
Lorsque les réponses inflammatoires ne sont pas résolues et persistent dans le temps, elles peuvent conduire à des dommages systémiques, affectant les tissus de manière hétérogène. L'inflammation chronique est associée à de nombreuses pathologies humaines distinctes sur le plan étiologique, notamment le cancer, les troubles auto-inflammatoires et auto-immuns, mais aussi les maladies métaboliques, les troubles neurodégénératifs et d'autres maladies non transmissibles.
L'objectif du laboratoire Base moléculaire de l'inflammation est de cartographier les voies régissant l'activation, le maintien et la résolution des réponses inflammatoires. Nous souhaitons découvrir les mécanismes moléculaires qui régissent les réponses inflammatoires spécifiques aux tissus. Nos recherches actuelles portent sur l'étude des réponses inflammatoires déclenchées par des espèces d'acides nucléiques pathologiques, notamment les ADN double brins et simple brins et les hybrides ADN:ARN. Ces entités peuvent apparaître dans le cytosol à la suite d'un stress génotoxique ou mitochondrial ou d'une infection par un agent pathogène. Bien qu'ils soient tous connus pour déclencher des processus inflammatoires, il est également bien établi qu'ils favorisent des signatures spécifiques au type cellulaire, qui peuvent à leur tour favoriser des réponses tissulaires différentielles. Pour déterminer comment la dérégulation des processus inflammatoires favorise les pathologies, nous combinons un large éventail d'approches, allant des études mécanistiques in vitro au phénotypage in vivo. La combinaison de plusieurs échelles d'étude nous permettra de décrire l'impact des acides nucléiques pathologiques sur les voies cellulaires et d'évaluer leur impact au niveau de l'organisme entier, en identifiant potentiellement des nœuds de signalisation clés sur lesquels on peut agir pour entraver l'inflammation pathologique. En résumé :
• Au niveau moléculaire : nous identifions et caractérisons de nouvelles voies impliquées dans le déclenchement de pathologies inflammatoires,
• Au niveau cellulaire : nous caractérisons la façon dont ces voies sont régulées en fonction de l'identité cellulaire,
• Au niveau tissulaire : nous étudions comment l'hétérogénéité cellulaire au sein des tissus dicte l'issue de la réponse inflammatoire et a un impact sur l'homéostasie.
• Au niveau de l'organisme : nous étudions les réponses inflammatoires et les conséquences de leur activation pathologique sur des modèles intégrés in vivo.
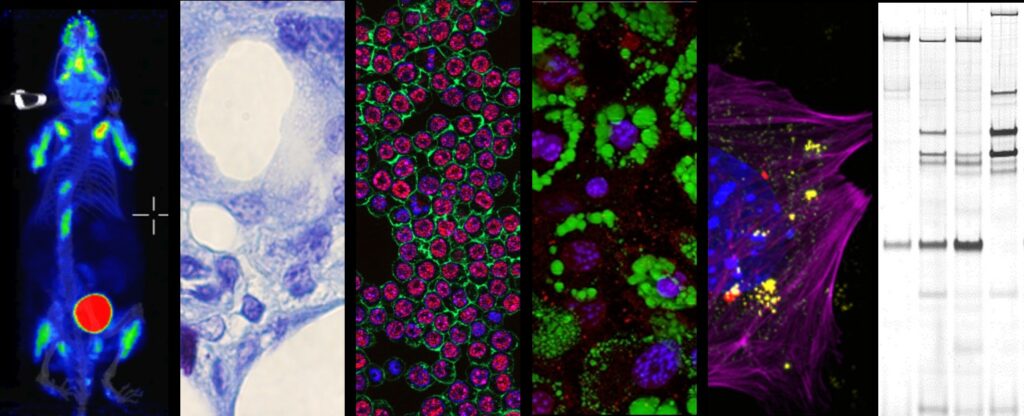
Les intérêts actuels de l'équipe Bases moléculaires de l'inflammation s’articulent autour du thème de l'immunité induite par les acides nucléiques cytosoliques. Les acides nucléiques pathologiques susceptibles de déclencher des réponses inflammatoires comprennent les ADN double brins (dsDNA) et simple brins (ssDNA) et les hybrides ADN:ARN cytosoliques. Ces espèces moléculaires peuvent s’accumuler dans le cytosol suite à une infection, un stress génotoxique ou mitochondrial et/ou d'une activité aberrante des rétro-éléments endogènes. Plusieurs voies de détection des acides nucléiques cytosoliques ont été décrites au cours de la dernière décennie. Néanmoins, les mécanismes moléculaires qui sous-tendent leur activation et leur coordination restent mal décrits. En outre, pour chaque acide nucléique, les réponses inflammatoires qui s'ensuivent, ainsi que les conséquences physiopathologiques associées, sont régies par des paramètres qui restent à découvrir.
Les principaux projets de l'équipe visent à décrire les mécanismes moléculaires impliqués dans l'activation de l'immunité associée aux acides nucléiques, à étudier leur conservation évolutive et à comprendre comment ils alimentent l'inflammation pathologique et les altérations tissulaires spécifiques.
Les projets développés par l'équipe comprennent :
- Détection et régulation des hybrides ADN:ARN cytosoliques dans la tumorigenèse
- Nouvelles voies de détection des acides nucléiques cytosoliques
- La coordination entre les réponses inflammatoires et métaboliques
- Contrôle de la chromatine dans les réponses inflammatoires
- Détection et régulation de l'ADN simple brin dans les réponses inflammatoires chroniques et aiguës
- Les dinucléotide cyclique dans le contrôle des réponses inflammatoires et physiologiques
- Exploitation des co-régulateurs des voies de détection des acides nucléiques pour stimuler les réponses antitumorales
1.Détection et régulation des hybrides ADN:ARN cytosoliques dans la tumorigenèse

Nous avons montré que l'activité de transcription inverse (RT) associée aux rétro-éléments endogènes génère des acides nucléiques cytosoliques susceptibles de déclencher des réponses inflammatoires. Ces acides nucléiques sont reconnus par la voie cGAS-STING, qui est centrale dans la détection des acides nucléiques cytosoliques. L'activation de cette voie de signalisation alimente notamment l'inflammation chronique associée au syndrome de prédisposition au cancer de l'anémie de Fanconi (Brégnard et al. EBioMed, 2016).Nous nous sommes ensuite concentrés sur l'identification des voies régulant les acides nucléiques pro-inflammatoires générés par la RT - en particulier les hybrides ADN:ARN. Nous avons identifié la Lysyl-tRNA synthetase (LysRS), un acteur clé de la traduction des protéines, comme étant impliquée dans la régulation de l'inflammation associée aux hybrides ADN:ARN cytosoliques (Guerra et al. Science Adv, 2020).
Actuellement, nous étudions l'impact de LysRS sur la tumorigenèse, notamment dans le contexte de l'adénocarcinome pancréatique (PDAC).
2.Nouvelles voies de détection des acides nucléiques cytosoliques

Le stress génotoxique est un phénomène complexe impliquant de nombreuses interactions moléculaires et modifications post-traductionnelles, induites par l'instabilité génétique et le stress réplicatif. Les protéines impliquées dans la réponse au stress génotoxique sont des régulateurs directs de la réponse immunitaire innée via (i) leur capacité à reconnaître les structures d'acide nucléique non canoniques, y compris les ADN endogènes présents dans le cytosol, et (ii) la régulation de la réparation de l'ADN. Nos travaux récents ont établi que le complexe DNA-PK, impliqué dans la réparation des cassures double brin de l’ADN, joue un rôle majeur dans l'activation de la voie canonique cGAS-STING de des ADN double brins cytosoliques (Taffoni et al EMBOJ 2022). En utilisant des approches in vivo et in vitro, nous avons montré que DNA-PK et cGAS coopèrent pour induire les réponses inflammatoires associées au cancer, régulant ainsi l'étendue des réponses immunitaires antitumorales.
Nous étudions actuellement si la coopération de ces deux voies pourrait être exploitée pour stimuler les réponses antitumorales ou, au contraire, prévenir les réponses inflammatoires délétères qui favorisent le cancer.
3.La communication entre les réponses inflammatoires et métaboliques

L'inflammation chronique peut être alimentée par les régimes gras, qui favorisent des altérations concertées des voies inflammatoires et métaboliques. Nous avons récemment identifié la protéine STING, qui joue un rôle central dans la production d'interférons de type I en présence d'acides nucléiques cytosoliques, comme un régulateur central du métabolisme des acides gras polyinsaturés (AGPI) (Vila et al. Cell Metabolism 2022). Nous explorons la communication entre ces voies inflammatoires et métaboliques, au niveau cellulaire, tissulaire et du corps entier, pour révéler leur impact sur le maintien de l'homéostasie et dans les pathologies inflammatoires chroniques.
Dans ce but :
(i) nous étudions le rôle des déséquilibres de désaturation des AGPI dans les pathologies présentant une inflammation chronique dépendante de STING,
(ii) Nous cherchons à déterminer si la régulation métabolique est la fonction primordiale de STING,
(iii) Nous étudions comment les réponses interféron sont régulées dans les cellules métaboliques.
4.Contrôle de la chromatine dans les réponses inflammatoires
Bien que la plupart des acides nucléiques responsable de l’induction de réponses inflammatoires soient détectés dans le cytosol, les protéines médiatrices de cette reconnaissance sont essentiellement nucléaires et associées à la chromatine lorsqu'elles sont inactives. C'est par exemple le cas de la protéine cGAS, qui joue un rôle central dans la détection des acides nucléiques dans le cytosol. Nos travaux actuels montrent que la présence cytosolique d'acides nucléiques entraîne la mobilisation de nombreuses protéines de la chromatine, au-delà des récepteurs déjà décrits. Nous étudions les conséquences de la mobilisation cytosolique des protéines nucléaires et leur impact sur la régulation des réponses inflammatoires.
5.Détection et régulation de l'ADN ss dans les réponses inflammatoires chroniques et aiguës

Physiologiquement, les ADNs simple brins apparaissent dans les cellules lors du stress réplicatif et de la résolution des dommages causés à l'ADN. Dans les cellules cancéreuses et dans certaines pathologies immunitaires, les ADNs simble brins cytosoliques sont associés à une déclenchement de la signalisation inflammatoire. De plus, l’ADN simple bring peut être un motif moléculaire associé à un pathogène (PAMP) et survenir lors d'une infection virale. Contrairement à l'ADN double brin cytosolique, les mécanismes et les conditions de détection de l’ADN simple brin sont mal définis. Nous souhaitons améliorer la compréhension de la détection de ces mécanismes ainsi que les voies et les modulateurs impliqués.
6.Les dinucléotides cycliques dans le contrôle des réponses inflammatoires et physiologiques

Le second messager AMP-GMP cyclique (cGAMP) est synthétisé par la cGAMP synthase (cGAS) après détection des acides nucléiques cytosoliques. Le cGAMP est le principal activateur de la protéine adaptatrice STING et joue donc un rôle crucial dans l'activation de l'interféron de type I et dans les réponses inflammatoires. La production de cGAMP est un processus étroitement régulé pour lequel, par exemple, nous avons montré que le complexe de réparation de l'ADN DNA-PK est nécessaire (Taffoni et al, EMBOJ 2022). Au-delà de cette fonction de cGAMP dans l'activation de STING, il apparait que les dinucléotides cycliques sont impliqués dans de nombreux processus cellulaires, telles que la régulation du métabolisme des acides gras polyinsaturés (Vila et al Cell Metabolism 2022). De plus, les dinucléotides cycliques d'origine bactérienne peuvent déclencher des réponses inflammatoires dans les cellules hôtes en cas d'infection. L'ensemble de ces données suggère que les dinucléotides cycliques tels que le cGAMP sont des acteurs majeurs dans la régulation de l'homéostasie.
Nous étudions actuellement les mécanismes moléculaires impliqués dans la régulation de la production, de la propagation et de la dégradation des dinucléotides cycliques.
7.Exploiter les co-régulateurs des voies de détection des acides nucléiques pour renforcer les réponses antitumorales
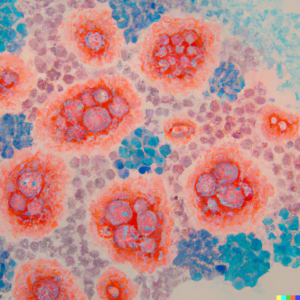
La protéine adaptatrice STING est une cible d'intérêt croissant pour la réactivation de l'immunité antitumorale. Nous avons identifié plusieurs partenaires de STING et screené des inhibiteurs et des co-activateurs, parmi lesquels des cibles thérapeutiques ont été validées. Nous souhaitons valider l'efficacité des combinaisons thérapeutiques identifiées pour leur capacité à stimuler les réponses antitumorales dans des modèles précliniques de cancer du sein, de mélanome et d'adénocarcinome pancréatique.
All Publications
Towards a novel approach to stimulate anti-tumoral immunity in glioblastoma. Taffoni C, Laguette N. Med Sci (Paris). 2023 Nov;39(11):813-815. doi: 10.1051/medsci/2023149. PMID: 38018919
Editorial: Broadening our view on nucleic acid sensing: novel sensors, signaling pathways, and involvement in non-infectious diseases. Chauveau L, Laguette N, Sampaio NG. Front Immunol. 2023 Aug 11;14:1266732. doi: 10.3389/fimmu.2023.1266732. eCollection 2023. PMID: 37638050
Multiplexed targeted analysis of polyunsaturated fatty acids and oxylipins using liquid chromatography-tandem mass spectrometry. Turtoi E, Jeudy J, Valette G, Enjalbal C, Vila IK, Laguette N, Turtoi A. STAR Protoc. 2023 Aug 17;4(3):102226. doi: 10.1016/j.xpro.2023.102226. PMID: 37597187
The unexpected role of the STING protein in lipid metabolism. Vila IK, Laguette N. C R Biol. 2023 Apr 18;346:29-33. doi: 10.5802/crbiol.110. PMID: 37254782
Dietary restriction induces a sexually dimorphic type I interferon response in mice with gene-environment interactions. Harney DJ, Cielesh M, Roberts GE, Vila IK, Viengkhou B, Hofer MJ, Laguette N, Larance M. Cell Rep. 2023 Jun 27;42(6):112559. doi: 10.1016/j.celrep.2023.112559. May 26. PMID: 37243595
Harnessing the cooperation between DNA-PK and cGAS in cancer therapies: The cooperation between DNA-PK and cGAS shapes tumour immunogenicity. Taffoni C, Schüssler M, Vila IK, Laguette N. Bioessays. 2023 Jul;45(7):e2300045. doi: 10.1002/bies.202300045. May 5. PMID: 37147791
DNA damage repair kinase DNA-PK and cGAS synergize to induce cancer-related inflammation in glioblastoma. Taffoni C, Marines J, Chamma H, Guha S, Saccas M, Bouzid A, Valadao AC, Maghe C, Jardine J, Park MK, Polak K, De Martino M, Vanpouille-Box C, Del Rio M, Gongora C, Gavard J, Bidère N, Song MS, Pineau D, Hugnot JP, Kissa K, Fontenille L, Blanchet FP, Vila IK, Laguette N. EMBO J. 2022 Dec 27:e111961. doi: 10.15252/embj.2022111961. Online ahead of print. PMID: 36574362
Regulation of innate immunity by Nrf2. van der Horst D, Carter-Timofte ME, van Grevenynghe J, Laguette N, Dinkova-Kostova AT, Olagnier D. Curr Opin Immunol. 2022 Oct;78:102247. doi: 10.1016/j.coi.2022.102247. Epub 2022 Sep 26. PMID: 36174411
Alternative pathways driven by STING: From innate immunity to lipid metabolism. Vila IK, Guha S, Kalucka J, Olagnier D, Laguette N. Cytokine Growth Factor Rev. 2022 Dec;68:54-68. doi: 10.1016/j.cytogfr.2022.08.006. Epub 2022 Sep 1.PMID: 36085258 Review.
Activation of STING in the pancreatic tumor microenvironment: A novel therapeutic opportunity. Chamma H, Vila IK, Taffoni C, Turtoi A, Laguette N. Cancer Lett. 2022 Jul 10;538:215694. doi: 10.1016/j.canlet.2022.215694. Epub 2022 Apr 27. PMID: 35489447 Review.
Protocol to induce and assess cGAS-STING pathway activation in vitro. Chamma H, Guha S, Laguette N, Vila IK. STAR Protoc. 2022 May 14;3(2):101384. doi: 10.1016/j.xpro.2022.101384. eCollection 2022 Jun 17. PMID: 35600929
STING orchestrates the crosstalk between polyunsaturated fatty acid metabolism and inflammatory responses. Vila IK, Chamma H, Steer A, Saccas M, Taffoni C, Turtoi E, Reinert LS, Hussain S, Marines J, Jin L, Bonnefont X, Hubert M, Schwartz O, Paludan SR, Van Simaeys G, Doumont G, Sobhian B, Vlachakis D, Turtoi A, Laguette N. Cell Metab. 2022 Jan 4;34(1):125-139.e8. doi: 10.1016/j.cmet.2021.12.007. PMID: 34986331
Editorial: Nucleic Acid-Associated Inflammation. Laguette N, Langevin C, Olagnier D, Torraca V, Vanpouille-Box C, Verrier ER. Front Immunol. 2021 Oct 27;12:791580. doi: 10.3389/fimmu.2021.791580. eCollection 2021. PMID: 34777401
Nucleic Acid Immunity and DNA Damage Response: New Friends and Old Foes. Taffoni C, Steer A, Marines J, Chamma H, Vila IK, Laguette N. Front Immunol. 2021 Apr 26;12:660560. doi: 10.3389/fimmu.2021.660560. eCollection 2021. PMID: 33981307 Review.
Animal Models for the Study of Nucleic Acid Immunity: Novel Tools and New Perspectives. Vila IK, Fretaud M, Vlachakis D, Laguette N, Langevin C. J Mol Biol. 2020 Sep 18;432(20):5529-5543. doi: 10.1016/j.jmb.2020.08.016. Epub 2020 Aug 26. PMID: 32860771. Review.
Lysyl-tRNA synthetase produces diadenosine tetraphosphate to curb STING-dependent inflammation. Guerra J, Valadao AL, Vlachakis D, Polak K, Vila IK, Taffoni C, Prabakaran T, Marriott AS, Kaczmarek R, Houel A, Auzemery B, Déjardin S, Boudinot P, Nawrot B, Jones NJ, Paludan SR, Kossida S, Langevin C, Laguette N. Sci Adv. 2020 May 22;6(21):eaax3333. doi: 10.1126/sciadv.aax3333. eCollection 2020 May. PMID: 32494729
V1b vasopressin receptor trafficking and signaling: Role of arrestins, G proteins and Src kinase. Perkovska S, Méjean C, Ayoub MA, Li J, Hemery F, Corbani M, Laguette N, Ventura MA, Orcel H, Durroux T, Mouillac B, Mendre C. Traffic. 2018 Jan;19(1):58-82. doi: 10.1111/tra.12535. PMID: 29044966
Upregulated LINE-1 Activity in the Fanconi Anemia Cancer Susceptibility Syndrome Leads to Spontaneous Pro-inflammatory Cytokine Production. Brégnard C, Guerra J, Déjardin S, Passalacqua F, Benkirane M, Laguette N. EBioMedicine. 2016 Jun;8:184-194. doi: 10.1016/j.ebiom.2016.05.005. Epub 2016 May 6. PMID: 27428429
Shaping of the host cell by viral accessory proteins. Laguette N, Benkirane M. Front Microbiol. 2015 Feb 23;6:142. doi: 10.3389/fmicb.2015.00142. eCollection 2015. PMID: 25755653
DNA damage repair machinery and HIV escape from innate immune sensing. Brégnard C, Benkirane M, Laguette N. Front Microbiol. 2014 Apr 22;5:176. doi: 10.3389/fmicb.2014.00176. eCollection 2014. PMID: 24795708
Premature activation of the SLX4 complex by Vpr promotes G2/M arrest and escape from innate immune sensing. Laguette N, Brégnard C, Hue P, Basbous J, Yatim A, Larroque M, Kirchhoff F, Constantinou A, Sobhian B, Benkirane M. Cell. 2014 Jan 16;156(1-2):134-45. doi: 10.1016/j.cell.2013.12.011. Epub 2014 Jan 9. PMID: 24412650
Phosphorylation of SAMHD1 by cyclin A2/CDK1 regulates its restriction activity toward HIV-1. Cribier A, Descours B, Valadão AL, Laguette N, Benkirane M. Cell Rep. 2013 Apr 25;3(4):1036-43. doi: 10.1016/j.celrep.2013.03.017. Epub 2013 Apr 17. PMID: 23602554
SAMHD1 restricts HIV-1 reverse transcription in quiescent CD4(+) T-cells. Descours B, Cribier A, Chable-Bessia C, Ayinde D, Rice G, Crow Y, Yatim A, Schwartz O, Laguette N, Benkirane M. Retrovirology. 2012 Oct 23;9:87. doi: 10.1186/1742-4690-9-87. PMID: 23092122
Role of SAMHD1 nuclear localization in restriction of HIV-1 and SIVmac. Brandariz-Nuñez A, Valle-Casuso JC, White TE, Laguette N, Benkirane M, Brojatsch J, Diaz-Griffero F. Retrovirology. 2012 Jun 12;9:49. doi: 10.1186/1742-4690-9-49. PMID: 22691373
SAMHD1 restricts the replication of human immunodeficiency virus type 1 by depleting the intracellular pool of deoxynucleoside triphosphates. Lahouassa H, Daddacha W, Hofmann H, Ayinde D, Logue EC, Dragin L, Bloch N, Maudet C, Bertrand M, Gramberg T, Pancino G, Priet S, Canard B, Laguette N, Benkirane M, Transy C, Landau NR, Kim B, Margottin-Goguet F. Nat Immunol. 2012 Feb 12;13(3):223-228. doi: 10.1038/ni.2236. PMID: 22327569
Evolutionary and functional analyses of the interaction between the myeloid restriction factor SAMHD1 and the lentiviral Vpx protein. Laguette N, Rahm N, Sobhian B, Chable-Bessia C, Münch J, Snoeck J, Sauter D, Switzer WM, Heneine W, Kirchhoff F, Delsuc F, Telenti A, Benkirane M. Cell Host Microbe. 2012 Feb 16;11(2):205-17. doi: 10.1016/j.chom.2012.01.007. Epub 2012 Feb 1. PMID: 22305291
How SAMHD1 changes our view of viral restriction. Laguette N, Benkirane M. Trends Immunol. 2012 Jan;33(1):26-33. doi: 10.1016/j.it.2011.11.002. Epub 2011 Dec 15. PMID: 22177690
SAMHD1 is the dendritic- and myeloid-cell-specific HIV-1 restriction factor counteracted by Vpx. Laguette N, Sobhian B, Casartelli N, Ringeard M, Chable-Bessia C, Ségéral E, Yatim A, Emiliani S, Schwartz O, Benkirane M. Nature. 2011 May 25;474(7353):654-7. doi: 10.1038/nature10117. PMID: 21613998



