Le chaperon R2TP recrute HSP90 pour assembler de nombreuses nanomachines cellulaires, dont les ARN polymérases et les kinases régulatrices PIKKs. Dans l’intestin, ce processus a lieu dans les cellules en prolifération et est essentiel à l’homéostasie tissulaire. Lorsqu’il est inactivé, des voies de signalisation entraînent l’arrêt du cycle et la mort cellulaire. Par ailleurs, le R2TP est un facteur de mauvais pronostic chez les patients souffrant d’un cancer colorectal. Ces travaux, publiés dans la revue Nature Communications, montrent pour la première fois des liens entre assemblage de complexes protéiques et croissance cellulaire normale ou pathologique.
L’expression des gènes en entités fonctionnelles repose sur la transcription des gènes en ARNm, leur traduction en protéines, le repliement de celles-ci dans leur forme finale, et, très souvent, leur incorporation dans des complexes macromoléculaires fonctionnels. En effet, la plupart des protéines ne sont actives qu’une fois intégrées dans des complexes contenant plusieurs sous-unités, qui fonctionnent alors comme des nanomachines. C’est notamment le cas des ARN polymérases, responsables de la transcription de l’ADN en ARN, des ribosomes, qui décodent les ARNm en chaînes polypeptidiques, des complexes TORC1 et TORC2 comprenant mTOR, qui régulent la synthèse protéique en fonction de l’état nutritionnel de la cellule. Si l’activité de ces nanomachines fait l’objet de nombreuses études, en revanche leur assemblage à partir de sous-unités individuelles est encore mal connu.
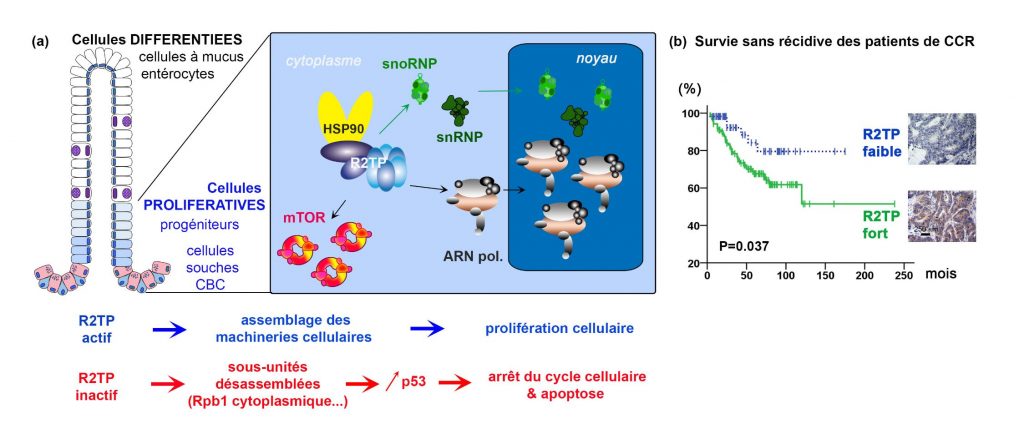
HSP90 est une chaperone impliquée dans le repliement de nombreux substrats. L’activité de HSP90 implique différents adaptateurs, chacun spécialisé pour un lot de substrats. Depuis une quinzaine d’année, un nouvel adaptateur, nommé R2TP, a été identifié. Le R2TP a d’abord été découvert pour son rôle dans la construction des snoRNP, de petites particules de protéines et d’ARN non-codants qui assurent la maturation des ribosomes. Par la suite, il est apparu que le R2TP assemblait d’autres nanomachines essentielles dans la cellule, dont (a) d’autres particules contenant des ARN non-codants (snRNP, miRNP), (b) les ARN polymérases responsables de la transcription de l’ADN en ARN, (c) les complexes fonctionnels de mTOR, dont l’activité kinase régule la croissance et la prolifération cellulaire, ainsi que (d) les complexes d’ATR, ATM et DNA-PKcs, des kinases qui signalent et réparent les dommages à l’ADN. De fait, la liste des substrats du R2TP ne cesse de croître, si bien que d’autres substrats restent probablement à découvrir. Le R2TP mobiliserait l’activité de HSP90 pour terminer le repliement des protéines substrats et permettre leur incorporation au sein de nanomachines actives. Cependant, les mécanismes d’assemblage sous-jacents restent mal compris, ainsi que le rôle du R2TP dans les tissus et les organismes.
Sous la coordination de Berengere Pradet Balade (CRBM) et avec la participation de l’équipe Hahne de l’IGMM, quatre équipes de Montpellier ont collaboré pour répondre à cette question. Dans cette étude, les scientifiques montrent que le R2TP est essentiel à l’homéostasie tissulaire. Des modèles murins d’invalidation conditionnelle dans l’épithélium intestinal ont montré le rôle essentiel du R2TP dans le maintien de l’homéostasie épithéliale. En effet, le R2TP est indispensable à la prolifération des cellules souches et progénitrices intestinales. Son inactivation induit des voies de signalisation qui convergent vers l’arrêt du cycle et la mort cellulaire de ce compartiment prolifératif. En conséquence, l’épithélium intestinal, un des tissus ayant le renouvellement le plus rapide du corps, ne peut se renouveler et dégénère. De fait, la sensibilité des tissus à l’inactivation du R2TP est corrélée à la vitesse du renouvellement tissulaire : l’intestin grêle murin, renouvelé en 3-4 jours, se dégrade avant le côlon qui se renouvèle plus lentement. De plus, l’inactivation du R2TP empêche la formation in vitro d’organoïdes intestinaux et coliques, avec des cinétiques qui reflètent les observations histologiques. Ces données montrent le rôle essentiel du chaperon R2TP et de sa fonction d’assemblage dans la prolifération des cellules intestinales.
Dans les coupes histologiques d’intestin, l’inactivation du R2TP provoque une accumulation cytoplasmique de Rpb1, la sous-unité catalytique de l’ARN polymérase II. Cette accumulation est visible dans les cellules souches et les progéniteurs intestinaux, mais pas dans les cellules différenciées. Cette accumulation traduit l’incapacité de Rpb1 à s’assembler avec ses partenaires en une ARN polymérase fonctionnelle, qui serait ensuite adressée au noyau. Ce phénotype coïncide avec une activation de la voie p53 et l’arrêt du cycle cellulaire. La protéine p53 est connue, entre autres, pour être un senseur de défaut dans la production des ribosomes, via une interaction directe avec des protéines ribosomales non incorporées. Une possibilité fascinante, qui reste à démontrer, serait que p53 fonctionne également comme senseur de l’assemblage d’autres nanomachines cellulaires.
Enfin, une corrélation a été observée entre l’espérance de vie et les niveaux de R2TP dans des patients souffrant d’un cancer colorectal. Le R2TP apparaît donc comme un facteur de mauvais pronostic chez ces patients.
A voir aussi sur les actualités de l’INSB
Pour en savoir plus :
The HSP90/R2TP assembly chaperone promotes cell proliferation in the intestinal epithelium
Maurizy C, Abeza C, Lemmers B, Gabola M, Longobardi C, Pinet V, Ferrand M, Paul C, Bremond J, Langa F, Gerbe F, Jay P, Verheggen C, Tinari N, Helmlinger D, Lattanzio R, Bertrand E, Hahne M, Pradet-Balade B.
Nature Communications. 10 août 2021. doi: 10.1038/s41467-021-24792-4.
Scientists contact :
Bérengère PRADET-BALADE Chercheuse CNRS pradet@crbm.cnrs.fr (+33) 4 34 35 95 48 CRBM (CNRS/UM) 1919, route de Mende 34293 Montpellier Cedex 05
Michael HAHNE Directeur de recherche Inserm michael.hahne@igmm.cnrs.fr (+33) 4 34 35 96 39 IGMM (CNRS/UM) 1919, route de Mende 34293 Montpellier Cedex 05
Edouard BERTRAND Directeur de recherche CNRS edouard.bertrand@igh.cnrs.fr (+33) 4 34 35 99 21 IGH (CNRS/UM) 141, rue de la Cardonille 34094 Montpellier Cedex 5