Notre groupe a un intérêt de longue date pour l'inflammation et la tumorigenèse. Nous avons une solide expérience dans l'étude des membres de la famille du Tumor Necrosis Factor (TNF) et nous avons identifié et caractérisé le rôle biologique du ligand analogue au TNF, le A Proliferation Inducing Ligand (APRIL). Nous avons découvert qu'APRIL agit comme une cytokine pléiotrope qui atténue l'inflammation et favorise les malignités des cellules B et le cancer colorectal (CRC). Notre expertise dans les modèles murins d'inflammation intestinale et de carcinogenèse a initié plusieurs nouveaux projets et collaborations, comme l'illustre notre récente publication dans Journal of Clinical Investigation décrivant un rôle bifonctionnel de la cycline A2 dans le CRC (doi : 10.1172/JCI131517). Plus récemment, nous avons commencé à nous intéresser à un aspect encore peu étudié des modifications post-traductionnelles spécifiques dans le CRC et les maladies inflammatoires.
Composition du groupe :
Michael Hahne (DR2), Benedicte Lemmers (CRCN), Valerie Pinet (CRHC), Conception Paul (IEHC), Monica Gabola (PhD student), Maya Sarieddine (PhD student), Cyrine Chanchabi (AI), Vanessa Pires (AI), Asma Majoul (Master student).
En 2021, l'équipe précédemment dirigée par Urszula Hibner, travaillant sur les maladies inflammatoires du foie et le carcinome hépatocellulaire (CHC), s'est associée à notre groupe, ce qui renforce encore notre expertise et nous permettra d'étendre nos recherches à différents types de tumeurs gastro-intestinales. Le groupe, désormais dirigé par Damien Grégoire, étudie la coopération oncogénique dans la carcinogenèse hépatique (voir ci-dessous pour un descriptif des projets de recherche).
Le cancer colorectal (CCR) est l'une des principales causes de décès liés à une tumeur maligne dans le monde, avec une incidence croissante. Il reste un problème majeur de santé publique nécessitant l'identification de nouveaux biomarqueurs et de nouvelles cibles thérapeutiques. En collaboration avec l'équipe Mamessier (CRCM Marseille), nous avons combiné des modèles de souris et une méta-analyse des données transcriptomiques de patients pour évaluer le rôle de la cycline A2 dans le CRC. Bien que des niveaux élevés de cycline A2 aient été fréquemment associés à un mauvais pronostic chez les patients atteints de cancer, notre étude montre que des niveaux élevés de CCNA2 (l'ARNm codant pour la cycline A2) peuvent représenter un marqueur pronostique favorable dans le CRC.
L'état pathologique des patients peut être classé en fonction du grade histologique de la tumeur (différenciation) et de l'étendue anatomique de la maladie (c'est-à-dire (TNM, tumeurs/nœuds/métastases, stades I-IV), qui décrit la croissance de la tumeur dans la paroi du rectum ou du côlon (stade II), l'atteinte des ganglions lymphatiques régionaux (stade III) et la propagation métastatique à d'autres organes (stade IV). Une méta-analyse récemment décrite, qui a identifié l'existence d'au moins 4 sous-types moléculaires de consensus (CMS) distincts basés sur l'expression génétique, à savoir le sous-type immunitaire (CMS1), canonique (CMS2), métabolique (CMS3) et mésenchymateux (CMS4). Il est important de noter que les CMS reflètent les réponses aux traitements actuellement disponibles, comme l'illustre le fait que seuls les patients CMS2 répondent bien au traitement standard.
La cycline A2 est un régulateur établi de la prolifération cellulaire et a été utilisée pour le diagnostic moléculaire comme marqueur de prolifération. Jusqu'à présent, peu d'études ont examiné le rôle de la cycline A2 dans le développement tumoral in vivo en utilisant des souris génétiquement modifiées.
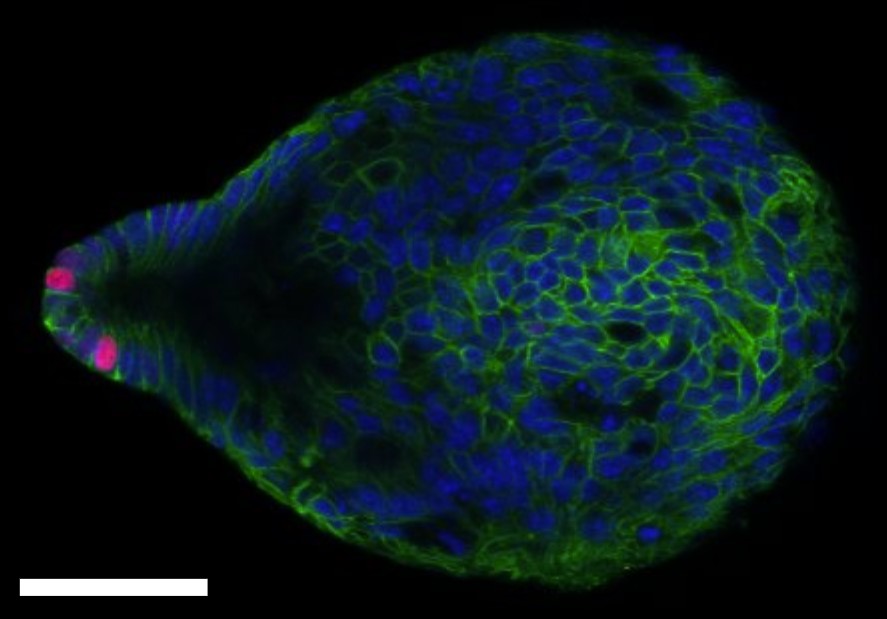
Pour clarifier la fonction de la cycline A2 dans l'homéostasie du côlon et le cancer colorectal (CCR), nous avons généré des souris déficientes en cycline A2 dans les cellules épithéliales du côlon (CEC). Le côlon de ces souris présentait des changements architecturaux dans la muqueuse, des signes d'inflammation ainsi qu'une prolifération accrue des CEC associée à l'apparition de dysplasie de bas et haut grade. Les principaux événements initiaux déclenchant ces altérations dans les CEC déficientes en cycline A2 semblent être des mitoses anormales et des dommages à l'ADN. De plus, nous avons détecté une activité accrue de la voie canonique WNT, connue pour être dérégulée dans divers cancers, notamment le CRC. La délétion de la cycline A2 dans les CEC a favorisé le développement de la dysplasie et des adénocarcinomes dans le modèle murin de cancer associé à la colite. Nous avons ensuite exploré le statut de l'expression de la cycline A2 dans les échantillons cliniques de CCR au niveau de l'ARNm et des protéines et avons trouvé une expression plus élevée dans les tumeurs des patients de stade I et II par rapport à celles de stade III et IV. Une méta-analyse de 11 ensembles de données transcriptomiques comprenant 2 239 tumeurs primaires du CCR a révélé différents niveaux d'expression de CCNA2 (l'ARNm codant pour la cyclineA2) parmi les sous-types de tumeurs du CCR, le plus élevé étant dans le CMS1 et le plus faible dans le CMS4, qui est le plus délétère. De plus, l'expression élevée de CCNA2 s'est avérée être un nouveau facteur indépendant de pronostic pour les tumeurs du CCR.
Nous concluons que le profil d'expression de la cycline A2 dans les tissus du CCR reflète des rôles distincts au cours de la carcinogenèse du côlon, tels que la conduite de la prolifération cellulaire aux stades précoces, lorsqu'elle est fortement exprimée, mais la promotion de l'agressivité aux stades ultérieurs, lorsque les niveaux d'expression sont plus faibles. Par conséquent, notre analyse de la cycline A2 illustre de manière frappante la complexité du cancer du côlon, à savoir qu'une protéine peut remplir des fonctions distinctes au cours du développement tumoral, ce qui complique le développement de stratégies thérapeutiques.
Le groupe Hahne concentre actuellement ses recherches sur le rôle des cils primaires et des modifications post-traductionnelles de la tubuline dans l'homéostasie et la pathologie du côlon. Pour cela, nous utilisons une approche expérimentale similaire à celle décrite pour le projet sur la cycline A2.
Sous-Groupe « Hétérogénéité tumorale des cancers du foie » (Supervision : D. Grégoire)
Composition :
Damien GREGOIRE (CRCN), Urszula HIBNER (DR1 émérite), Carine CHAVEY (CRCN), Eric ASSENAT (PU-PH), José URSIC-BEDOYA (PH), Marine BERNARDET (Doctorante), Guillaume DESANDRE (v). Benjamin RIVIERE (Anatomopathologiste).
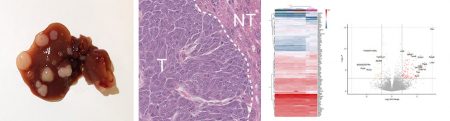
Le carcinome hépatocellulaire (CHC) est le principal cancer primitif du foie et la troisième cause de mortalité par cancer dans le monde. Les CHC sont des tumeurs hétérogènes, aussi bien par rapport à leurs signatures génomiques et à leurs caractéristiques histologiques. Malgré des progrès récents, les options thérapeutiques de ces tumeurs restent limitées. Dans l'optique du développement des nouvelles thérapies ciblées il est nécessaire de mieux comprendre cette maladie et en particulier appréhender comment le profil mutationnel de la tumeur définit la carcinogenèse.
Nos thèmes de recherche :
- Nous étudions des aspects fonctionnels de l'hétérogénéité tumorale, notamment en ce qui concerne la manière dont la composition génétique des sous-clones tumoraux façonne le micro-environnement tumoral. Dans ce contexte, nous étudions différentes combinaisons d'événements oncogéniques caractéristiques de plusieurs classes de CHC humains.
- Nous nous intéressons au dialogue entre des effets métaboliques et oncogéniques de FGF19 dont l'expression est dérégulée dans une sous-classe agressive de CHC
- Nous analysons des mutants "gain de fonction" du suppresseur de tumeurs p53 pertinents à la carcinogénèse hépatique
Nos modèles :
Notre travail est basé sur des modèles murins de pointe de carcinogenèse hépatique. Nous utilisons la technique de l'injection hydrodynamique aboutissant à la transfection in vivo d'hépatocytes et donc à la génération des tumeurs déclenchées par des nombreuses combinaisons oncogéniques. Nous avons également développé un modèle de xénogreffes orthotopiques de cellules transformées exprimant des marqueurs fluorescents, ce qui nous permet de les suivre in situ, ainsi que de les isoler et de les analyser ex vivo.
Nos études fournissent des informations sur les interactions entre les populations cellulaires des sous-clones tumoraux ainsi que sur celles entre la tumeur et son microenvironnement.
Plus d’information sur notre groupe de recherche ici.
Financeurs :
Nous sommes actuellement financés par l’ANR, INSERM, INCA , la Fondation ARC, le SIRIC Montpellier, l’AFEF
Sélection de publications récentes:
Asif, P. $, Longobardi, C. $, Hahne, M., Medema, JP, 2021. (Invited review). The Role of Cancer Associated Fibroblasts in Cancer Invasion and Metastasis. Cancers (Basel) 3(18):4720. doi: 10.3390/cancers13184720. $shared first authorship
Maurizy, C., Abeza, C., Lemmers, B., Gabola, M., Longobardi, C., Pinet, V., Ferrand, M., Paul, C., Bremond, J., Langa, F., Gerbe, F., Jay, P., Verheggen, C., Tinari, N., Helmlinger, D., Lattanzio, R., Bertrand, E.*, Hahne, M.*, Pradet-Balade, B.*, 2021. The R2TP chaperone assembles cellular machineries in intestinal CBC stem cells and progenitors. Nat Commun 12, 4810. doi: 10.1038/s41467-021-24792-4
Hussain, A., Deleuze, V., El Kebriti, L., Turali, H., Pirot, N., Glasson, Y., Mathieu, D., Pinet, V., 2021. In Lyl1-/- mice, adipose stem cell vascular niche impairment leads to premature development of fat tissues. Stem Cells 39, 78–91. https://doi.org/10.1002/stem.3286
Butterworth J.*/Grégoire D.*&, Peter M., Roca Suarez AA., Desandré G., Simonin Y., Virzi A., Zine El Aabidine A., Guivarch M., Andrau JC., Bertrand E., Assenat E., Lupberger J., Hibner U.& GOLT1B Activation in Hepatitis C Virus-Infected Hepatocytes Links ER Trafficking and Viral Replication, Pathogens, 2022, 11,46. https:// doi.org/10.3390/pathogens11010046.