La division asymétrique des cellules permet de générer des cellules diverses dans tous les domaines du vivant. Nous utilisons la levure de boulanger Saccharomyces cerevisiae comme modèle d’étude afin de comprendre les mécanismes et fonctions de la division cellulaire asymétrique.
Les cellules de levure sont aussi un très bon modèle de vieillissement cellulaire. Des dommages, notamment des agrégats protéiques, s’accumulent dans la cellule mère. Les processus de rétention de ces agrégats dans la cellule mère, qui permettent la jouvence de la cellule fille, sont encore mal compris. En addition de notre caractérisation des mécanismes de division cellulaire asymétrique, nous poursuivons l’idée que le vieillissement cellulaire permet aux cellules de faire émerger des mémoires de leurs adaptations passées afin de survivre à des stress futurs.
1.Les mnemons encodent des mémoires cellulaires.
Nous avons découvert un nouveau type de mémoire épigénétique lors des tentatives infructueuses de conjugaison (reproduction sexuelle) de la levure (Caudron & Barral, Cell, 2013). Lorsque deux cellules haploïdes de type sexuel opposé se rencontrent, elles communiquent en secrétant des phéromones sexuelles. Elles arrêtent alors leur cycle cellulaire dans la prochaine phase G1. Les partenaires sexuels forment une projection cytoplasmique que l’on nomme shmoo afin de se rejoindre. Lorsque les deux partenaires sont en contact, ils fusionnent et forment une cellule diploïde. Mais la vie n’est pas toujours si simple. Si les levures sont uniquement exposées à la phéromone, sans partenaire sexuel à proximité, elles forment un shmoo puis arrivent ensuite à échapper à l’arrêt du cycle cellulaire en phase G1. Elles peuvent alors produire de nouvelles cellules filles (reproduction végétative). Les cellules mères qui acquièrent cette adaptation la retiennent pour le reste de leur vie. En revanche, les cellules filles naissent naïves et répondent normalement à la phéromone pour former un shmoo (Figure 1).
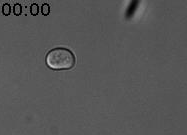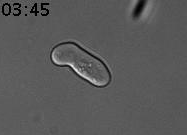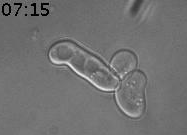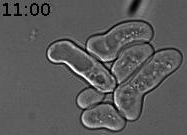
Figure 1. Cellule de levure exposée à la phéromone sexuelle (7nM). La cellule mère produit un shmoo puis, au bout d’un moment, reprend son cycle cellulaire pour produire des cellules filles. Celles-ci répondent à la phéromone. Temps en heures et minutes.
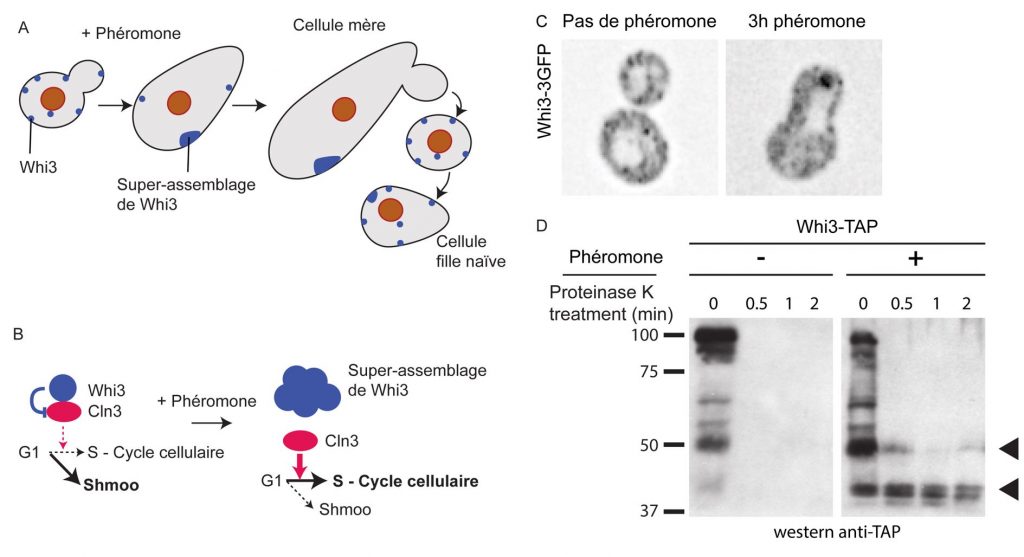
Figure 2. Schéma de la mémoire des tentatives infructueuses de conjugaison. A. Un cellule de levure répond à la phéromone en produisant un shmoo. Whi3 s’assemble lentement, permettant à la cellule d’échapper à l’arrêt du cycle cellulaire et de produire un bourgeon. La cellule fille nait naïve, sans super-assemblage de Whi3 et peut répondre à la phéromone. B. En réponse à la phéromone, Whi3 est inactivée par un changement de conformation. La traduction de l’ARNm de Cln3 n’est plus inhibée par Whi3. Cln3 peut alors activer le passage à la phase S du cycle cellulaire. C. Localisation de Whi3-3GFP dans des cellules exposées ou non à la phéromone. On peut noter le super-assemblage de Whi3 dans la cellule de droite. D. Caractérisation biochimique du changement de conformation de Whi3, qui devient partiellement résistante à la protéinase K en réponse à la phéromone.
L’état réfractaire à la phéromone dépend de l’inactivation de la protéine Whi3. Whi3 est un inhibiteur de l’ARNm qui code pour Cln3, la cycline G1 requise pour la transition de la phase G1 à la phase S du cycle cellulaire. Whi3 contient des domaines de type prion qui sont riches en asparagine et glutamine et qui induisent le changement de conformation de Whi3 en réponse à la phéromone sexuelle. Ce changement de conformation inactive l’inhibition de Whi3 sur l’ARNm de Cln3. Whi3 est donc est un mnemon, c’est-à-dire une protéine qui change de conformation pour former un super-assemblage et encoder une mémoire cellulaire. Les mnemons sont induits par un stimulus spécifique et sont hérités de façon asymétrique lors de la division cellulaire, ici retenu dans la cellule mère (Figure 2).
A l’inverse des mnemons, les prions ségrégent de façon symétrique lors de la division cellulaire. Nous avons observé que l’association de Whi3 avec les membranes du réticulum endoplasmique favorise sa rétention dans la cellule mère. Cet effet est dû à la compartimentation des membranes du réticulum endoplasmique par une barrière de diffusion au niveau du cou, la frontière entre la cellule mère et la future cellule fille. L’élimination génétique de la barrière de diffusion entraîne la transformation du mnemon Whi3 en prion qui maintenant ségrége de façon symétrique (Lau et al., Current Biology, 2022, Figure 3). Les protéines qui contiennent des domaines de type prion sont présentes dans la plupart des organismes vivants et un certain nombre d’entre elles causent des protéinopathies, comme par exemple des maladies neurodégénératives, la maladie de Creutzfeldt-Jakob ou encore la maladie de la vache folle. Nous testons l’hypothèse que beaucoup de ces protéines se comportent comme des mnemons, et nous visons à comprendre leur biologie dans des contextes physiologiques et pathologiques.
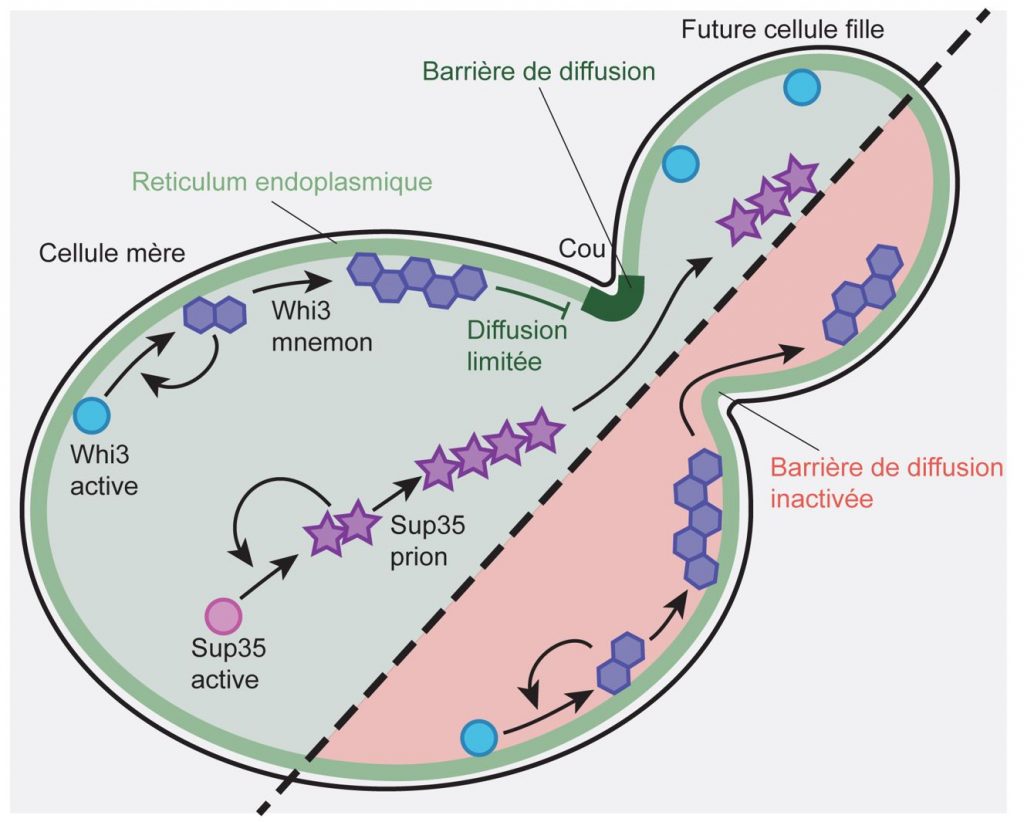
Figure 3. La protéine Whi3 peut changer de conformation de manière auto-réplicative dans la cellule mère (à gauche). Cette forme mnemon est associée aux membranes du réticulum endoplasmique. Une barrière de diffusion dans ces membranes (au cou) retient le mnemon dans la mère. Le prion Sup35, aussi auto-réplicatif peut diffuser librement entre la mère et la future fille. En éliminant la barrière de diffusion (partie basse), le mnemon Whi3 peut se comporter comme un prion et se propage dans la cellule fille.
2.Les protéines de type prion pendant le vieillissement.
Le vieillissement affecte la majorité des organismes vivants, entraînant un large spectre de déclins de fonctions physiologiques. Le vieillissement cellulaire s’accompagne de l’accumulation de protéines qui s’agrègent, probablement à cause de dommages structuraux. Dans la levure, ces protéines s’agrègent en un dépôt unique qui est retenu dans la cellule mère lors de la division cellulaire (Saarikangas et al., Current Biology, 2017, Figure 4). Nos objectifs sont, d’une part, de comprendre comment ces agrégats protéiques sont retenus dans la cellule mère et d’autre part d’identifier les mécanismes moléculaires dans les cellules vieillissantes qui induisent la formation de ces dommages protéiques. Nous nous intéressons plus spécifiquement aux protéines à domaines de type prion, puisque nous avons observé que le mnemon Whi3 agrège dans des vieilles cellules (Schlissel et al., Science, 2017, Figure 4). Pour cela nous utilisons des puces microfluidiques et de la microscopie afin de suivre les cellules de levures pendant toute leur courte vie.

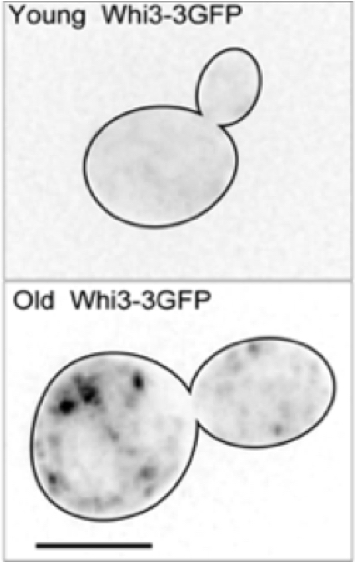
Figure 4. Le panel de gauche montre un film d’une vieille cellule de levure qui exprime la protéine Hsp104-GFP. L’agrégat de Hsp104-GFP (le focus noir) est retenu dans la mère lors de la division cellulaire. Le panneau de gauche montre une jeune cellule (en haut) qui exprime Whi3-3GFP. Le signal est globalement diffus, alors que dans une vieille cellule (en bas), Whi3-3GFP forme des agrégats.
3.Identification de molécules qui agissent contre le vieillissement.
La population mondiale vieillit. Nous espérons que les aspects détrimentaux du vieillissement puissent être retardés afin d’assurer une vie saine le plus longtemps possible. Dans ce contexte, nous avons identifié que la molécule tripentadecanoin peut retarder les effets du vieillissement dans la levure, en inhibant la formation des agrégats protéiques (Oamen et al., BioRXiv, 2021, Figure 5). Nous poursuivons nos recherches concernant le mécanisme de fonctionnement moléculaire du tripentadecanoin et espérons pouvoir identifier d’autres molécules qui ont la capacité de retarder le vieillissement.
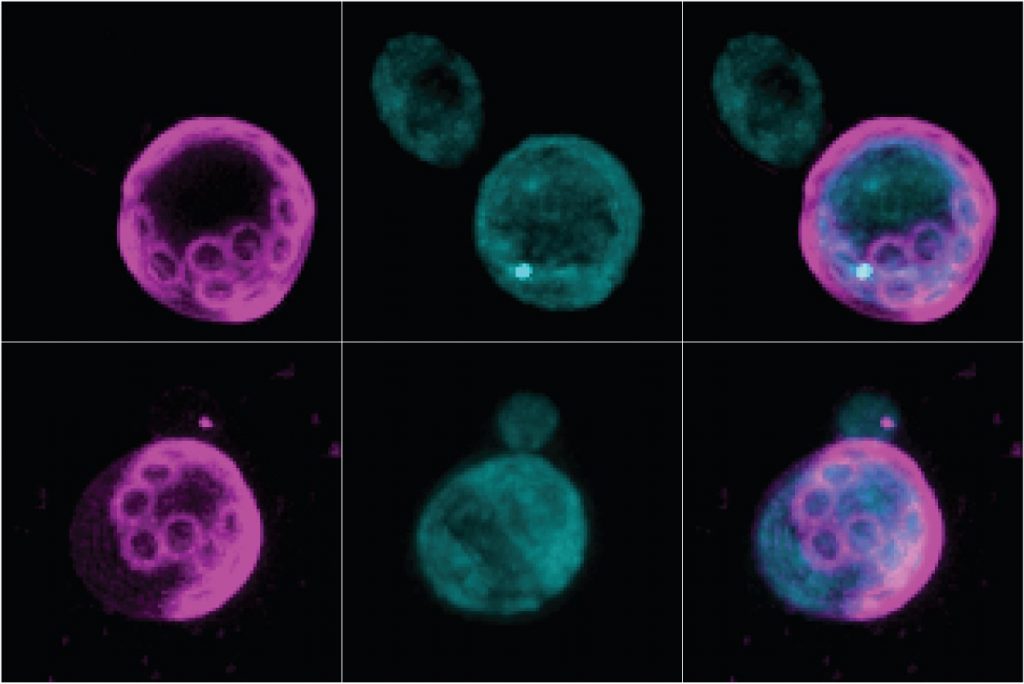
Figure 5. Les cicatrices de bourgeonnement (les cercles à gauche) dénotent l’âge des vieilles cellules. La protéine Hsp104-GFP forme un agrégat induit par le vieillissement (focus, panel du milieu, en haut). Dans les vieilles cellules traitées avec du tripentadecanoin (panel du milieu, en bas), cet agrégat n’est pas présent, et ces cellules vivent plus longtemps.
Selection of publications :
Whi3 mnemon association with endoplasmic reticulum membranes confines the memory of deceptive courtship to the yeast mother cell. Lau, Y., Oamen, H.P., Grogg, M., Parfenova, I., Saarikangas, J., Hannay, R., Nichols, R.A., Hilvert, D., Barral, Y., and Caudron, F. (2022). Current Biology.
Aggregation of the Whi3 protein, not loss of heterochromatin, causes sterility in old yeast cells. Schlissel, G., Krzyzanowski, M.K., Caudron, F., Barral, Y., and Rine, J. (2017). Science 355, 1184–1187.
A super-assembly of Whi3 encodes memory of deceptive encounters by single cells during yeast courtship. Caudron, F., and Barral, Y. (2013). Cell 155, 1244–1257.
List of all the publications :
1. A rare natural lipid induces neuroglobin expression to prevent amyloid oligomers toxicity and retinal neurodegeneration. Oamen, H.P., Romero, N.R., Knuckles, P., Saarikangas, J., Dong, Y., and Caudron, F. (2021). bioRxiv, 20. https://doi.org/10.1101/2021.06.23.449608
2. Whi3 mnemon association with endoplasmic reticulum membranes confines the memory of deceptive courtship to the yeast mother cell. Lau, Y., Oamen, H.P., Grogg, M., Parfenova, I., Saarikangas, J., Hannay, R., Nichols, R.A., Hilvert, D., Barral, Y., and Caudron, F. (2022). Current Biology.
3. Mnemons and the memorization of past signaling events. Reichert, P., and Caudron, F. (2021). Curr Opin Cell Biol 69, 127–135. PMID: 33618243
4. Prion-like proteins as epigenetic devices of stress adaptation. Oamen, H.P., Lau, Y., and Caudron, F. (2020). Experimental Cell Research 396, 112262. PMID: 32896568
5. Protein Phase Separation during Stress Adaptation and Cellular Memory. Lau, Y., Oamen, H.P., and Caudron, F. (2020). Cells 9, 1302. PMID: 32456195
6. Meeting report – shining light on septins. Caudron, F., and Yadav, S. (2018). Journal of Cell Science 131. PMID: 29360625
7. A Droplet to Sense Sugar Drops. Barral, Y., and Caudron, F. (2017). Molecular Cell 68, 1017–1019. PMID: 29272701
8. Spatial regulation of coalesced protein assemblies: Lessons from yeast to diseases. Saarikangas, J., and Caudron, F. (2017). Prion 259, 1–12. PMID: 28574744
9. Protein aggregation triggers a declining libido in elder yeasts that still have a lust for life. Caudron, F. (2017). Microbial Cell 4, 200–202. PMID: 28660204
10. Compartmentalization of ER-Bound Chaperone Confines Protein Deposit Formation to the Aging Yeast Cell. Saarikangas, J., Caudron, F., Prasad, R., Moreno, D.F., Bolognesi, A., Aldea, M., and Barral, Y. (2017). Current Biology 27, 773–783. PMID: 28262489
11. Aggregation of the Whi3 protein, not loss of heterochromatin, causes sterility in old yeast cells. Schlissel, G., Krzyzanowski, M.K., Caudron, F., Barral, Y., and Rine, J. (2017). Science 355, 1184–1187. PMID: 28302853
12. A role for the yeast CLIP170 ortholog, the plus-end-tracking protein Bik1, and the Rho1 GTPase in Snc1 trafficking. Boscheron, C., Caudron, F., Loeillet, S., Peloso, C., Mugnier, M., Kurzawa, L., Nicolas, A., Denarier, E., Aubry, L., and Andrieux, A. (2016). Journal of Cell Science 129, 3332–3341. PMID: 27466378
13. A sphingolipid-dependent diffusion barrier confines ER stress to the yeast mother cell. Clay, L., Caudron, F., Denoth-Lippuner, A., Boettcher, B., Buvelot Frei, S., Snapp, E.L., and Barral, Y. (2014). eLife 3, e01883. PMID: 24843009
14. [Sex and memory: what yeast can teach us]. Caudron, F., and Barral, Y. (2014). Médecine Sciences 30, 348–349. PMID: 24801024
15. Mnemons: encoding memory by protein super-assembly. Caudron, F., and , Barral, Y. (2014). Microbial Cell 1, 100–102. PMID: 28357228
16. A super-assembly of Whi3 encodes memory of deceptive encounters by single cells during yeast courtship. Caudron, F., and Barral, Y. (2013). Cell 155, 1244–1257. PMID: 24315096
17. Bud building by septin patch hole punching. Caudron, F., and Barral, Y. (2013). Developmental Cell 26, 115–116. PMID: 23906060
18. Mutation of Ser172 in yeast β tubulin induces defects in microtubule dynamics and cell division. Caudron, F., Denarier, E., Thibout-Quintana, J.-C., Brocard, J., Andrieux, A., and Fourest-Lieuvin, A. (2010). PloS One 5, e13553. PMID: 21042413
19. Oscillations in Cdc14 release and sequestration reveal a circuit underlying mitotic exit. Manzoni, R., Montani, F., Visintin, C., Caudron, F., Ciliberto, A., and Visintin, R. (2010). The Journal of Cell Biology 190, 209–222. PMID: 20660629
20. Septins and the lateral compartmentalization of eukaryotic membranes. Caudron, F., and Barral, Y. (2009). Developmental Cell 16, 493–506. PMID: 19386259
21. [A diffusion barrier allows budding yeast rejuvenation]. Caudron, F. (2009). Médecine Sciences 25, 217–218. PMID: 19361377
22. A new role for kinesin-directed transport of Bik1p (CLIP-170) in Saccharomyces cerevisiae. Caudron, F., Andrieux, A., Job, D., and Boscheron, C. (2008). Journal of cell science 121, 1506–1513. PMID: 18411245




