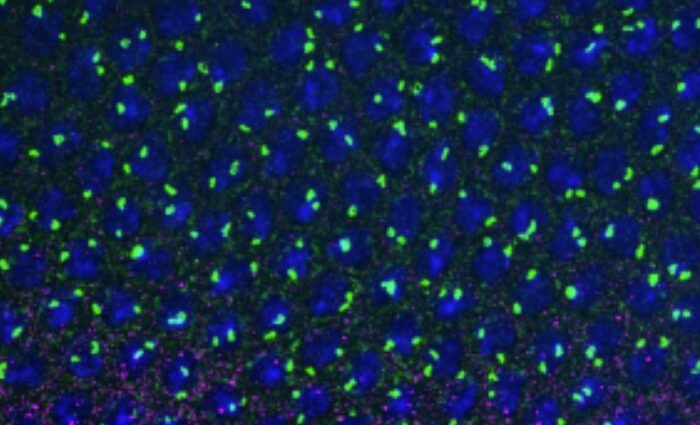
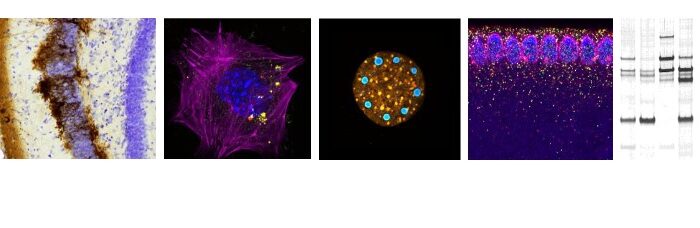
Les changements métaboliques qui contrôlent la différenciation séquentielle des cellules souches et progénitrices humaines (CSPH) vers des érythrocytes matures restent encore mal compris. Dans cet article, nous montrons que le développement de CSPH vers un proérythroblaste entraîne une augmentation de la glutaminolyse, générant de l’alpha-cétoglutarate (aKG) et conduisant à une augmentation de la phosphorylation oxydative mitochondriale (OXPHOS). Cependant, les stades tardifs de l’érythropoïèse sont dépendants d’une diminution de l’OXPHOS liée à l’aKG, et nous avons déterminé que l’isocitrate déshydrogénase (IDH1) joue un rôle central dans ce processus. La réduction de l’expression de l’IDH1 augmente l’oxydation mitochondriale de l’aKG et inhibe la génération de réticulocytes. De plus, le « knockdown » de l’IDH1 entraîne la génération d’érythroblastes multinucléés, une anomalie morphologique caractéristique du syndrome myélodysplasique et d’anémies dysérythropoïétiques congénitales. Par ailleurs, nous avons identifié la vitamine C comme un régulateur critique de l’érythropoïèse inefficace ; ainsi, alors que l’ascorbate oxydé augmente la production de superoxyde mitochondriaux et exacerbe considérablement le phénotype anormal des progéniteurs avec un niveau d’IDH1 altéré, la vitamine C, qui piège les espèces réactives de l’oxygène (ROS) et la reprogrammation du métabolisme mitochondrial, restaure l’érythropoïèse. Ainsi, le « crosstalk » IDH/vitamine C contrôle les étapes terminales de la différenciation érythroïde humaine.
Cell Reports 2021 34 Gonzalez Menendez
A voir aussi sur les actualités de l’INSB