Les modificateurs post-traductionnels peptidiques de la famille de l’ubiquitine (Ubiquitin-like UbL) sont conjugués réversiblement à des milliers de protéines cellulaires dont ils modifient l'activité, la fonction et/ou le devenir. De cette manière, les UbL joue un rôle aussi important que les phosphorylations dans virtuellement tous les processus cellulaires. En particulier, ils sont essentiels au contrôle de l'expression des gènes et dérégulés dans une variété de situations pathologiques.
Dans ce contexte, nous étudions comment les UbL et plus particulièrement SUMO, en particulier au travers de leur capacité à réguler les programmes d'expression géniques, sont impliqués dans la réponse des Leucémies Aiguës Myéloïdes (LAM) aux thérapies, les LAM étant des hémopathies malignes avec un pronostic sombre dont le traitement n'a pas significativement changé en 40 ans.
Ces dernières années, nous avons montré que la SUMOylation contrôle la réponse des LAM aux chimiothérapies (anthracyclines telles que la daunorubicine ou l'idarubicine et analogues nucléosides tels que l'aracytine) utilisés dans les traitements standard de la LAM (Bossis et al., Cell Reports, 2014) ainsi qu'aux thérapies de différenciation utilisant l'acide all-trans-rétinoïque (Baik et al., Cancer Research 2018). En outre, nous avons montré que la dérégulation de l'activité des enzymes de SUMOylation et d'ubiquitylation est associée à la résistance de la LAM aux chimiothérapies standard (Gâtel et al., Life Science Alliance, 2020) et pourrait servir de biomarqueur de la réponse de la LAM à ces traitements (brevet EP19305688, 2019).
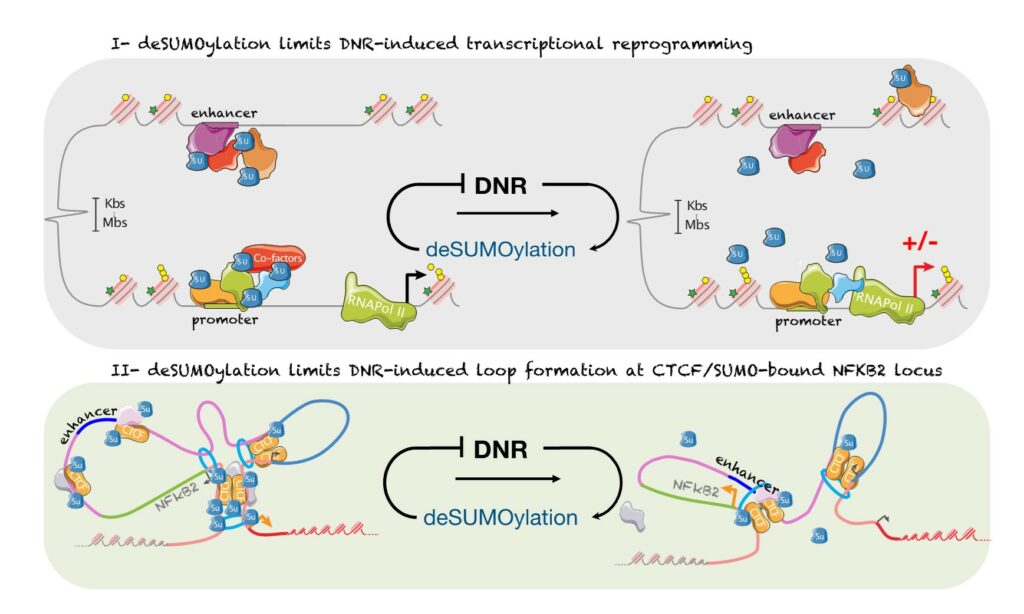
La SUMOylation contrôle la reprogrammation transcriptionnelle rapide induite par les chimiothérapies dans la LAM
Nous avons montré que la daunorubicine, le principal médicament chimiothérapeutique utilisé dans la LAM, induit une reprogrammation transcriptionnelle rapide dans les cellules leucémiques, avec près de 1000 gènes régulés à la hausse ou à la baisse en moins de 3 heures. Cette reprogrammation est précédée d'une déconjugaison massive de SUMO de ses protéines cibles, en particulier celles liées aux promoteurs et aux enhancers. Cette déSUMOylation limite la reprogrammation transcriptionnelle induite par la DNR. Nous avons ensuite étudié plus en détail NFKB2, l'un des principaux gènes induits par la DNR. Nos données suggèrent que la DNR induit la formation d'une boucle médiée par CTCF entre son promoteur et un enhancer distal, ce qui pourrait expliquer l'induction de NFKB2. Enfin, l'inhibition de la SUMOylation empêche la formation de la boucle et l'induction du gène NFKB2. Ainsi, nos travaux apportent un éclairage nouveau sur le mode d'action des chimiothérapies (Boulanger et al., Nucleic Acids Research, 2023)
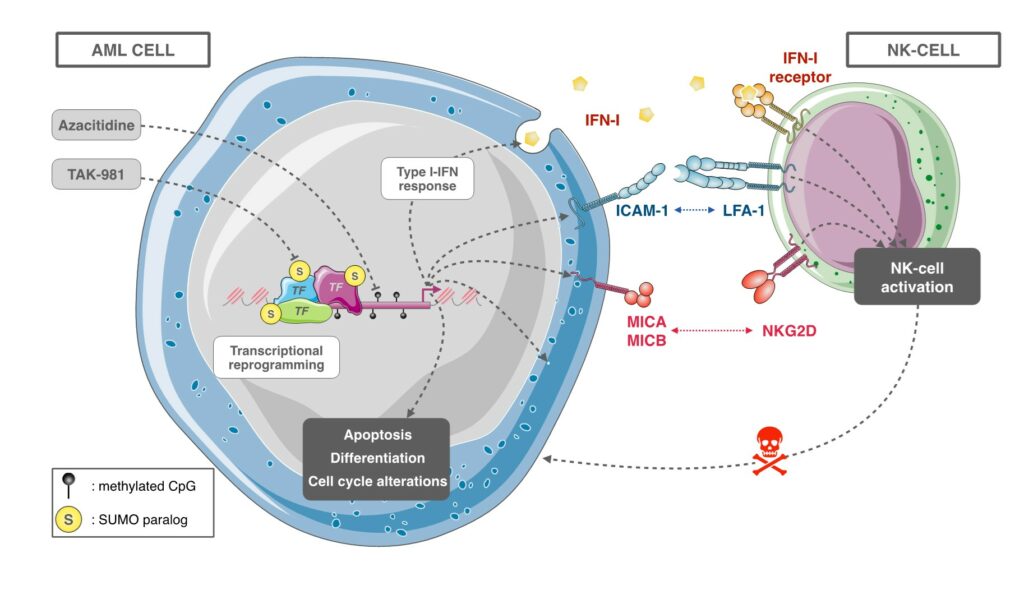
L'inhibiteur de SUMOylation TAK-981 synergise avec l'azacitidine dans des modèles précliniques de leucémies myéloïdes aiguës et limite l'échappement immunitaire
La découverte récente du TAK-981 (Subasumstat), un premier inhibiteur de SUMOylation, nous a permis de tester dans des modèles précliniques la pertinence thérapeutique du ciblage de la voie SUMO dans la LAM. Nous avons pu montrer que TAK-981 est doté d'une puissante activité anti-leucémique dans divers modèles précliniques de LAM. TAK-981 cible les lignées cellulaires de LAM et les cellules blastiques des patients in vitro et in vivo dans des souris xénogreffées avec une toxicité minimale sur les cellules normales. En outre, il agit en synergie avec la 5-azacitidine (AZA), un agent hypométhylant de l'ADN désormais utilisé en association avec le venetoclax, un inhibiteur de la BCL-2, pour traiter les patients qui ne peuvent pas bénéficier des chimiothérapies standard. Il est intéressant de noter que la combinaison TAK-981+AZA présente une activité antileucémique plus élevée que la combinaison AZA+venetoclax in vivo, du moins dans le modèle testé. Mécaniquement, TAK-981 potentialise la reprogrammation transcriptionnelle induite par l'AZA, favorisant la différenciation et la mort des cellules leucémiques. De plus, le traitement par TAK-981+AZA induit de nombreux gènes liés aux voies de l'inflammation et de la réponse immunitaire. Il entraîne notamment la sécrétion d'interféron de type I (IFN-I) par les cellules de la LAM. Enfin, TAK-981+AZA induit l'expression de ligands activateurs de Natural Killer (NK) (MICA/B) et de protéines d'adhésion (ICAM-1) à la surface des cellules de la LAM. De manière cohérente, les cellules de la LAM traitées par TAK-981+AZA activent les NK et augmentent leur activité cytotoxique (Gabellier et al, Haematologica, 2023). Ainsi, le ciblage de la SUMOylation constitue une approche prometteuse dans les traitement des LAM pour à la fois sensibiliser les cellules cancéreuses à l’azacitidine et limiter leur capacité à échapper à la surveillance du système immunitaire.
Les objectifs de nos travaux actuels sont les suivants : mieux comprendre, au niveau moléculaire, le rôle de la SUMOylation dans (i) la réponse des LAM aux thérapies (chimiothérapies, thérapies de différenciation et thérapies à base d'épidrugs), (ii) l'activation d'une réponse immunitaire anti-tumorale, en particulier par l'activation des cellules Natural Killer. Nous visons également à valider, dans des modèles précliniques de LAM, l'efficacité du ciblage de la SUMOylation dans le traitement des LAM, seul ou en combinaison avec des thérapies existantes. Ces travaux sont menés en étroite collaboration avec le département d'hématologie clinique du CHU de Montpellier. Enfin, nous développons de nouveaux outils et molécules pour cibler la SUMOylation dans la LAM et plus généralement le cancer, en particulier grâce à notre collaboration avec l'équipe du Dr Muriel Amblard (IBMM).